高考资讯 所处位置:首页 > 高考资讯
高中化学水的电离和溶液的PH 北京家教中心
来源:北师大家教网
高中化学水的电离和溶液的PH
北京家教中心
北京家教中心资料:水的电离和溶液的PH
1.复习重点
1.通过对水的电离、离子积、pH定义等重要知识和方法迁移应用的练习,提高认知能力;
2.灵活解答水的电离平衡的相关问题;
3.掌握混合溶液pH计算的方法,并能运用数学工具解决一些有关pH计算的综合问题
4.培养学习过程中探究、总结的习惯。
2.难点聚焦
(一)溶液的酸碱性及pH的值
溶液呈的酸碱性何性,取决于溶液中[H+]、[OH—]的相对大小:pH值的大小取决于溶液中的[H+]大小
pH=-lg[H+],pOH=-lgKw=pKw
|
溶液酸碱性
|
[H+]与[OH—]关系
|
||
|
任意湿度
|
室温(mol/L)
|
pH值(室温)
|
|
|
酸性
|
[H+]>[OH—]
|
[H+]>1×10—7
|
<7
|
|
中性
|
[H+]=[OH—]
|
[H+]=[OH—]=1×10—7
|
=7
|
|
碱性
|
[H+]<[OH—]
|
[H+]>1×与10—7
|
>7
|
(1)酸性越强,pH值越小,碱性越强,pH值越大,pH值减小一个单位,[H+]就增大到原来的10倍,pH值减小n个单位,[H+]的增大到原来的10n倍.
(2)任意水溶液中[H+]≠0,但pH可为0,此时[H+]=1mol/L,一般[H+]>1mol/L时,pH<0,故直接用[H+]表示.
(3)判断溶液呈中性的依据为:[H0]= [OH—]或pH=pOH= pKw
pKw
只有当室温时,Kw=1×10—14
[H+]=[OH—]=10—7mol/L
溶液呈中性
pH=pOH= pKw=7
pKw=7
分析 原因:H2O  H++OH-Q
H++OH-Q
由于水的电离是吸热的,湿度越高,电离程度越大,kw越大.
中性:pH=pOH= pKw
pKw
T?→Kw?→pH+pOH?
T?→Kw?→pH=pOH?
如:100℃,KW=1×10—12.. pKw=12.
中性时Ph= pKw=6<7.
pKw=6<7.
图示:不同湿度(T1>T2)时溶液中[H+]与[OH—],pH与pOH关系
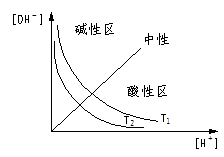 图一
图一 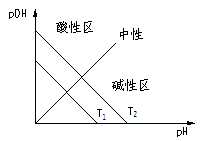 图二
图二 想一想:图一与图二有哪些不同?为何不同?
提示:(①形状 ②T1、T2相对位置)
③简平分钱划分的两个区域酸碱性不同。建议以[H+]、[OH—]=Kw,和pH+pOH=pKw两个关系或考虑,并注意湿度不同时Kw的影响。)
(4)溶液pH的测定方法:
①酸碱指示剂 ②pH试纸 ③pH计其中①只传判定pH范围
②pH试纸也只能确定在某个值左右(对照标准比色卡),无法精确到小数点后1倍。另外使用时不能预先润湿试纸。否则相当于又稀释了待测液,测定结果误差大。
③pH计测定较精确.
(二)酸碱溶液的稀释前后pH值的变化。
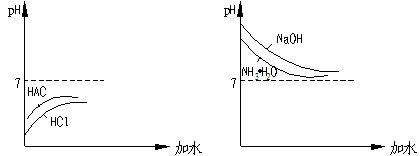
由于强酸或强碱在水中完全电离,加水稀释后不会有溶质进一步电离,故仅仅是体积增大的因素导致酸溶液中的[H+]或碱溶液中的[OH—]减小.弱酸或弱碱由于在水中不完全电离,加水稀释同时,能促使其分子进一步电离,故导致相应[H+]或[OH—]减小的幅度降低。
例如 ①等物质的量浓度的盐酸和醋酸,氢氧化钠和氨水分别加水稀释。溶液的pH值变化,图示如下:
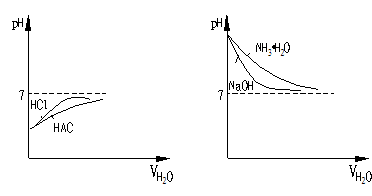
②若把上述问题,换成等pH值,图示又怎样呢?
强酸弱酸稀释 强、弱碱稀释
前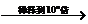 后 前
后 前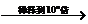 后
后
pH=a pH(HCl)=a+n<7 pH=b Ph(NaOH)=b-n>7
pH(HAC)<a+n<7 pH(NH3·H2C)>b-n>7
△pH(HCl)=n △pH(NaOH)=n
△pH(HAC)<n △pH(NH3·H2O)<n
△pH(HCl)>△pH(HAC) △pH(NaOH)>△pH(NH3·H2O)
注意:
①酸无论怎样稀释,不可能成为碱性;若无限稀释,则pH只能无限接近7且小于7.
②碱无论怎样稀释,不可能成为酸性;若无限稀释,则pH只能无限接近7且大于7
③当起始强酸、弱酸的pH相同,稀释后为达仍相同,则稀释倍数一定是弱酸大小强酸(强碱、弱碱类同)
(三)有关pH的计算
1.溶液简单混合(不发生反应,忽略混合时体积变化)
强酸:pH=pH小+0.3
若等体积混合,且△pH≥2
强碱:pH=pH大-0.3
若不等体积混合,物质的量浓度 强酸[H+]总=
分别为M1、M2体积分别为 强碱[OH—]总=
V1、V2的一元强酸或强碱
注意:强酸直接由[H+]总求pH值
强碱由[OH—]总求pOH,后再求pH值.
2.强酸和强碱混合(发生中和反应,忽略体积变化)可能情况有三种:
①若酸和碱恰好中和. 即nH+=nOH—,pH=7.
②若酸过量,求出过量的[H+],再求pH值.
③若碱过量,求出过量的[OH—],求出pOH后求pH值.
特例:若强酸与强碱等体积混合
①若pH酸+pH碱=14,则完全中和pH=7.
②若pH酸+pH碱>14,则碱过量pH≈pH碱-0.3
③若pH酸+pH碱<14,则酸过量pH≈pH酸+0.3
讨论:
pH=a的HCl溶液和pH=b的NaOH溶液按体积比V1 :V2混合.当混合液分别呈中性、酸性、碱性时,且V1 :V2=10n时,a+b分别为多少?
分析 ①呈中性:即pH=7.
nH+=nOH—
10—a·V1=10—(14-b)·V2
V1 :V2=10—14+a+b
10n=10a+b-14
n=a+b-14
a+b=14+n
②若呈酸性. 即pH<7
nH+>nOH—
10—a·V1>10—(14-b)·V2
V1 :V2>10—14+a+b
10n>10-14+ a+b
a+b<14+n
③若呈碱性,即pH>7,同理可知
a+b>14+n
想一想:若V1 :V2=1 :10n=10—n,三种情况的结果又如何呢?
3.关于酸、碱混合时的定性判断(常温)
酸与碱混合时发生中和反应,但不一定恰好完呈中和。即使恰好完全中和,也不一定溶液呈中性,由生成的盐能否水解及水解情况而定,另外酸碱的强弱不同,提供反应物的量不同也影响着反应后溶液的性质。一般酸或碱过量化生成的盐水解对溶液的酸碱性影响大。
下面把常见的几种情况分列出来.
①等物质的量浓度的一元弱酸一元强碱溶液等体积混合溶液pH>7(由生成的强碱弱酸盐水解决定)
②等物质的量浓度的一元强酸与一元弱碱溶液等体积混合后溶液pH<7(由生成的强酸弱碱盐水解决定)
③等物质的量浓度的一元强酸与强碱溶液等体积混合后溶液pH=7(因生成强酸强碱盐不水解)
想一想:若酸或碱之一是多元,情况又怎样?
④当pH=pOH的强酸与强碱溶液以等体积混合后pH=7(与酸、碱的几元性无尖)
⑤当pH=3的某一元酸溶液与pH=11的一元强碱以等体积混合后pH≤7。(考虑酸有强弱之分,若分弱酸,制反应后酸过量)
⑥当pH=3的某一元强酸pH=11的一元碱溶液的以等体积混合后pH≥7(同理⑤,弱碱过量)
⑦将pH=3的酸溶液和pH=11的碱溶液以等体积混合后溶液pH=无法确定.
再想一想:⑤⑥⑦与酸、碱的几元性有无关系?
3.例题精讲
知识点一:水的电离
【例1】(1)与纯水的电离相似,液氨中也存在着微弱的电离:2NH3 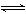 NH4++NH2-据此判断以下叙述中错误的是 ( )
NH4++NH2-据此判断以下叙述中错误的是 ( )
A.液氨中含有NH3、NH4+、NH2-等微粒
B.一定温度下液氨中C(NH4+)·C(NH2-)是一个常数
C.液氨的电离达到平衡时C(NH3) = C(NH4+) = C(NH2-)
D.只要不加入其他物质,液氨中C(NH4+) = C(NH2-)
(2)完成下列反应方程式
①在液氨中投入一小块金属钠,放出气体————————————————————————————
②NaNH2溶于水的反应——————————————————————————————————
③类似于“H++OH—=H2O”的反应————————————————————————————
解析:此题要求掌握水自偶的实质(水分子电离产生的H+与H2O结合形成H3O+)以及水的电离平衡,并能迁移应用于对于NH3电离的认识:NH3分子电离产生H+和NH2—,H+与NH3结合生成NH4+,液氨电离产生等量的NH2—与NH4+,一定温度下离子浓度乘积为一常数;NH4+类似于H+,NH2—类似于OH—。具备上述知识后,就可顺利完成解题。
答案:(1)C (2)①2Na+2NH3=H2↑+2NaNH2
②NaNH2+H2O=NaOH+NH3↑或NH2—+H2O=OH—+NH3↑
③NH2—+NH4+ =2NH3↑或NH4Cl+NaNH2=2NH3↑+NaCl
知识点二:水的离子积
【例2】某温度下纯水中C(H+) = 2×10-7 mol/L,则此时溶液中的C(OH-) = ___________。
若温度不变,滴入稀盐酸使C(H+) = 5×10-6 mol/L,则此时溶液中的C(OH-) = ___________。
解析:由水电离产生的H+与OH-量始终相等,知纯水中C(H+) = C(OH-)。根据纯水中C(H+) 与C(OH-)可求出此温度下水的Kw的值,由Kw的性质(只与温度有关,与离子浓度无关),若温度不变,稀盐酸中Kw仍为此值,利用此值可求出盐酸中的C(OH-)。
答案:纯水中 C(OH-) = C(H+) = 2×10-7 mol/L
Kw = C(H+)·C(OH-) = 2×10-7×2×10-7 = 4×10-14
稀盐酸中 C(OH-) = Kw / C(H+) = (4×10-14) / (5×10-6) = 8×10-9 mol/L
【例3】 .难溶化合物的饱和溶液存在着溶解平衡,例如:
AgCl(s)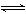 Ag++Cl—,Ag2CrO4(s)
Ag++Cl—,Ag2CrO4(s) 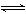 2Ag++CrO42—,在一定温度下,难溶化合物饱和溶液离子浓度的乘积为一常数,这个常数用Ksp表示。
2Ag++CrO42—,在一定温度下,难溶化合物饱和溶液离子浓度的乘积为一常数,这个常数用Ksp表示。
已知:Ksp(AgCl)=[Ag+][Cl-]=1.8×10-10
Ksp(Ag2CrO4)=[Ag+]2[CrO42-]=1.9×10-12
现有0.001摩/升AgNO3溶液滴定0.001摩/升KCl和0.001摩/升的K2CrO4的混和溶液,试通过计算回答:
(1)Cl-和CrO42-中哪种先沉淀?
AgCl(s)
已知:Ksp(AgCl)=[Ag+][Cl-]=1.8×10-10
Ksp(Ag2CrO4)=[Ag+]2[CrO42-]=1.9×10-12
现有0.001摩/升AgNO3溶液滴定0.001摩/升KCl和0.001摩/升的K2CrO4的混和溶液,试通过计算回答:
(1)Cl-和CrO42-中哪种先沉淀?
(2)当CrO42-以Ag2CrO4形式沉淀时,溶液中的Cl-离子浓度是多少? CrO42-与Cl-能否达到有效的分离?(设当一种离子开始沉淀时,另一种离子浓度小于10-5mol/L时,则认为可以达到有效分离)
解析:(1)当溶液中某物质离子浓度的乘积大于Ksp时,会形成沉淀。几种离子共同沉淀某种离子时,根据各离子积计算出所需的离子浓度越小越容易沉淀。(2)由Ag2CrO4沉淀时所需Ag+浓度求出此时溶液中Cl—的浓度可判断是否达到有效分离。
解答:(1)AgCl饱和所需 Ag+浓度[Ag+]1=1.8×10-7摩/升
Ag2CrO4饱和所需Ag+浓度[Ag+]2=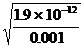 =4.36×10-5摩/升
=4.36×10-5摩/升
[Ag+]1<[Ag+]2,Cl-先沉淀。
(2) Ag2CrO4开始沉淀时[Cl-]=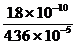 =4.13×10-6<10-5,所以能有效地分离。
=4.13×10-6<10-5,所以能有效地分离。
Ag2CrO4饱和所需Ag+浓度[Ag+]2=
[Ag+]1<[Ag+]2,Cl-先沉淀。
(2) Ag2CrO4开始沉淀时[Cl-]=
知识点三:水的电离平衡的移动
【例4】 :某溶液中由水电离出来的C(OH—)=10-12mol/L,则该溶液中的溶质不可能是( )
A、HCl B、NaOH C、NH4Cl D、H2SO4
解析:由水电离反应式知:此溶液水电离产生的C(H+)=C(OH—) =10-12mol/L,若溶液中的H+全部来自水的电离,则此溶液显碱性,是因溶有碱类物质所致,若溶液中的H+不仅为水电离所产生,则此溶液显酸性,为酸性物质电离所致。NH4Cl不可能电离产生H+。
解答:C
下列两题为上题的变式,分析一下变在何处?解题方法、思路与上题是否一样?差异何在?
(1)室温下,在纯水中加入某物质后,测得溶液中由水电离产生的C(H+)=10-12mol/L,则加入的物质可能是(假设常温下碳酸、氢硫酸的第一步电离度为0.1%)( )
A、通入CO2 B、通入H2S C、通入NH3 D、加入NaHSO4
(2)某溶液中水电离产生的C(H+)=10-3mol/L,,该溶液中溶质可能是( )
①Al2(SO4)3 ②NaOH ③NH4Cl ④NaHSO4
A、①② B、①③ C、②③ D、①④
【例5】能促进水的电离,并使溶液中C(H+)>C(OH—)的操作是 ( )
(1)将水加热煮沸 (2)向水中投入一小块金属钠 (3)向水中通CO2 (4)向水中通NH3 (5)向水中加入明矾晶体 (6)向水中加入NaHCO3固体 (7)向水中加NaHSO4固体
A、(1)(3)(6)(7) B、(1)(3)(6) C、(5)(7) D、(5)
解析:本题主要考查外界条件对水的电离平衡的影响,请按如下思路完成本题的解:本题涉及到哪些条件对水的电离平衡的影响?各自对水的电离平衡如何影响?结果任何(C(H+)与C(OH—)相对大小)?归纳酸、碱、盐对水的电离平衡的影响。
解答: D
知识点四:pH的定义方法
【例6】、下列溶液,一定呈中性的是( )
A.由等体积、等物质的量浓度的一元酸跟氢氧化钠溶液混合后所形成的溶液
B.[H+]=1×10-7mol·L-1的溶液
C.pH=14-pOH 的溶液
D.pH=pOH 的溶液 (2000年化学试测题)
解析:此题要求将教材中定义pH方法迁移应用于表示pOH以及pH与pOH的关系,根据pH的定义方法,可定义pOH= ?lgC(OH?),将室温下水的离子积的表达式C(H+)×C(OH—)=10?14两边取负对数,?lgC(H+)?lgC(OH?)= ?lg10?14,整理得pH+pOH=14。应用所得关系式分析可得答案。
解答:D
点评:pOH= ?lgC(OH?)、pH+pOH=14两个关系式及其应用均不在教学大纲和考纲范围内,我们不一定要掌握,但将教材中的知识、方法加以迁移应用,进行探究发现是教学大纲和考纲提出的能力要求。此题作为全国高考化学测试题具有重要的指导意义,值得大家认真去领悟,在随后的2001年上海高考题以及2002年全国理科综合高考题中又出现了类似的题目。
为更好地表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG=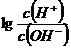 ,则下列叙述正确的是
,则下列叙述正确的是
A 中性溶液的AG=0
B 酸性溶液的AG<0
C 常温下0.lmol/L氢氧化钠溶液的AG=12
D 常温下0.lmol/L盐酸溶液的AG=12( 2001年上海)
有人曾建议用AG表示溶液的酸度(acidity arede),AG的定义为AG=lg([H+]/[OH-])。下列表述正确的是
A 在25℃时,若溶液呈中性,则pH=7,AG=1
B 在25℃时,若溶液呈酸性,则pH<7,AG<0
C 在25℃时,若溶液呈碱性,则pH>7,AG>0
D 在25℃时,溶液的pH与AG的换算公式为AG=2(7-pH) (2002理科综合)
知识点五:溶液pH的计算
【例7】室温下将n体积pH=10和m体积pH=13两种NaOH溶液混合得pH=12的NaOH溶液,则n:m=——————————————
解析:此题是关于两种不反应的溶液混合后溶液pH值的计算,根据混合前后溶质(NaOH)量守恒,列式求解
解答:pH=10 C(H+)=10-10mol/L C(OH—) =10-4mol/L
pH=13 C(H+)=10-13mol/L C(OH—) =10-1mol/L
pH=12 C(H+)=10-12mol/L C(OH—) =10-2mol/L
10-4·n + 10-1·m = (n+m) ×10-2
n :m = 100 :11
规律:有关混合溶液的pH计算,题设条件可千变万化,正向、逆向思维,数字与字母交替出现,但基本题型只有两种:(1)混合后不反应,(2)混合后反应。对于溶液的稀释,可将水作为浓度为0的溶液,仍属混合后不反应一类,这一类混合溶液的pH应介于两种溶液的pH之间,因而酸、碱溶液无论加多少水稀释,其最终pH均不可能等于纯水的pH(即常温不可能为7)。
混合溶液pH的计算方法也很简单,即设法求出混合溶液的C(H+),若是溶液显碱性,则必须先求出溶液的C(OH—),然后再换算为C(H+)或按OH—量守恒列式求解。
【例8】25ºC,若10体积的某强碱溶液与1体积的某强酸溶液混合后,溶液呈中性,则混合之前,该碱的pH与强酸的pH之间该满足的关系是_______________________
分析:由题意知,本题为酸、碱混合后完全中和,根据中和反应的实质可知,酸中n(H+)与碱中n(OH-)相等,故有C(H+)酸V酸 == C(OH-)碱V碱,由此关系列式可求得结果。
解答:设酸的pH为a,C(H+)酸=10-a,碱的pH为b,C(OH-)碱=10-14 / 10-b=10- (14 - b)
因为混合后溶液呈中性,所以C(H+)酸V酸 == C(OH-)碱V碱
10-a ×V = 10 - (14 - b) ×10V = 10 - (13 - b) ×V
10-a = 10 - (13 - b)
两边取负对数:-lg10-a = -lg10 - (13 - b),a=13-b a+b=13
即酸的pH与碱的pH之和为13
点评:上面解法尽管可顺利地得出本题的解,但题中的酸碱体积比可以任意变换,则每一变换都得重新求解,这就启发我们能否找出酸、碱pH与两者体积比之间的关系呢?同时若混合后不显中性其关系又会怎样呢?
将上面的解改为:
C(H+)酸V酸 == C(OH-)碱V碱
10-a ×V酸 = 10 - (14 - b) ×V碱
10-a·10-b=10-14·(V碱 / V酸)
两边取负对数得:a+b=14?lg(V碱 / V酸)
若混合后溶液显酸性————————————————————————:
若混合后溶液显碱性—————————————————————————:
同学们在学习中要善于总结、积累,把自己积累的经验、成果用于指导自己的学习。例如掌握了上述关系后,解下列题目就很轻松。在20℃时,有PH值为x(x£6)的盐酸和PH值为y(y³8)的NaOH溶液,取Vx升该盐酸同该NaOH溶液中和,需Vy升NaOH溶液
(1)若x+y=14时,则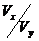 =
=
(1)若x+y=14时,则
(2)若x+y=13时,则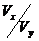 =
=
(3)若x+y>14时,则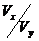 = (表达式),且Vx Vy(填<、>或=)
= (表达式),且Vx Vy(填<、>或=)
4.实战演练
一 选择题
1.水是一种极弱的电解质,在室温下平均每n个水分子只有一个水分子能电离,则n是 ( )
A.1×10-4 B. 55.6×107 C. 1×107 D. 6.02×1021
2.将1mol·L-1H2SO4溶液100mL与质量分数为10%的NaOH溶液50g混合均匀后,滴入甲基橙指示剂,此时溶液的颜色是 ( )
A.浅紫色 B.黄色 C.红色 D.无色
3.pH定义为pH=-lg{c(H+)},pOH定义为pOH=-lg{c(OH-)},Kw表示25℃时水的离子积常数,则弱酸性溶液中的c(H+)可表示为 ( )
A、Kw/pOH mol/L B、10pOH-14 mol/L
C、10 14-pOH mol/L D、10-pOH mol/L
4.能使水的电离平衡正向移动,而且所得溶液呈酸性的是 ( )
A.将水加热到100℃时,水的pH=6 B.向水中滴加少量稀硫酸
C.向水中滴加少量NaHCO3 D.向水中加入少量明矾晶体
5. 常温下某溶液中水电离出的C(H+) = 1×10-13 mol/L,则下列说法中正确的是 ( )
A.该溶液一定呈酸性 B.该溶液一定呈碱性
C.该溶液中一定有C(OH-) = 0.1mol/L D.该溶液的pH值为1或13
6.25℃时,在水电离出的C(H+)=1×10-5摩/升的溶液中,一定能大量共存的是 ( )
A.Al3+、NH4+、SO42-、Cl- B. Mg2+、K+、SO42-、HCO3-
C.K+、Na+、Cl-、SO42- D.Ba2+、Cl-、Na+、PO43-
7.有①、②、③三瓶体积相等,浓度都是1mol/L的HCl溶液,将①加热蒸发至体积减小一半,在②中加入CH3COONa固体(加入后溶液仍呈酸性),③不作改变,然后以酚 酞作指示剂,用溶液滴定上述三种溶液,消耗的NaOH溶液的体积是 ( )
A、①=③>② B、③>②>① C、①=②=③ D、①<②=③
8.NH4Cl溶于重水(D2O)生成一水合氨和水合离子的化学式为 ( )
A、NH3·D2O和HD2O+ B、NH3·HDO和D3O+
C、NH2D·D2O和DH2O+ D、NH2D·HDO和D3O+
9.室温时,pH=10的氨水和Na2CO3溶液中,水电离产生的C(H+)前者与后者之比 ( )
A.1∶1 B.10¯10∶10¯4 C.10¯4∶10¯10 D10¯10∶10¯7
10.25℃,向VmLpH = a的NaOH溶液中滴加pH = b的盐酸10VmL时,溶液中Cl—的物质的量恰好等于加入Na+的物质的量,则此时(a+b)的值为 ( )
A、13 B、14 C、15 D、无法判断
11.在医院中,为酸中毒病人输液不应采用 ( )
A 0.9%氯化钠溶液 B 0.9%氯化铵溶液
C 1.25%碳酸氢钠溶液 D 5%葡萄糖溶液
12.若室温时PH=a的氨水与PH=b的盐酸等体积混和,恰好完全反应,则该氨水的电离度可表示为 ( )
A.10(a+b-12)% B.10(a+b-14)% C.10(12-a-b)% D.10(14-a-b)%
13.把40毫升Ba(OH)2溶液加入到120毫升盐酸中,所得的溶液的PH值为2。如果混和前Ba(OH)2和盐酸两种溶液PH值之和为14,则盐酸的物质的量浓度接近于 ( )
A.0.015摩/升 B.0.02摩/升 C.0.03摩/升 D.0.04摩/升
14.已知NaHSO4在水中的电离方程式为NaHSO4 =Na+ +H+ + SO42—。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液pH为2,对于该溶液,下列叙述不正确的是( )
A、该温度高于25℃
B、水电离出来的c (H+)=1.0×10-10 mol/L
C、c (H+)= c (OH—)+C(SO42—)
D、该温度下加入等体积pH值为12的NaOH溶液可使反应后的溶液恰好呈中性
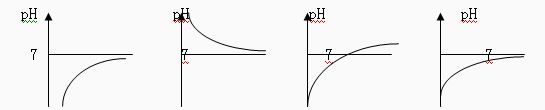
15.能表示人体大量喝水时,胃液的pH变化的是 ( )
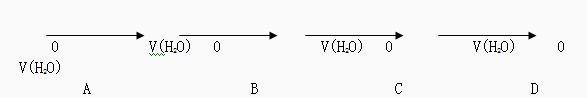
16.4体积pH=9的Ca(OH)2溶液跟1体积pH=13的NaOH溶液混合后,溶液中氢离子浓度为
A.5×10-13mol/L B.2×10-12mol/L
C.1/5(4×10-9 + 1×10-13)mol/L D.1/5(4×10-5 + 1×10-1)mol/L
17.a、b、c、d四种溶液PH值都小于7,已知四种溶液中[H+]和[OH-]之和由大到小的顺序是b>a>d>c,则这四种溶液PH值由大到小的顺序是 ( )
A.c>d>a>b B.b>a>d>c C.a>b>c>d D.无法确定
18. 有下列四种溶液:(1)HCl (2)AlCl3(3)NaOH (4)Na2CO3,此四种溶液中水的电离度分别为a1、a2、a3、a4已知a1=a3,a2=a4且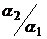 =106,则四种溶液的PH值不可能是
=106,则四种溶液的PH值不可能是
A、5 5 10 10 B、4 4 10 10
C、3 5 11 9 D、5 3 9 11
19.NaH是—种离子化合物,它跟水反应的方程式为:NaH+H2O→NaOH+H2↑,它也能跟液氨、乙醇等发生类似的反应,并都产生氢气。下列有关NaH的叙述错误的是
A 跟水反应时,水作氧化剂 B NaH中H-半径比Li+半径小
C 跟液氨反应时,有NaNH2生成 D 跟乙醇反应时,NaH被氧化
20、常温下某溶液,水电离出的c (OH-)=1.0×10-4 mol/L,该溶液中溶质可能是 ( )
①Al2(SO4)3 ②NaOH ③NH4Cl ④NaHSO4
A、①② B、①③ C、②③ D、①④
二 填空题
21.测得某溶液的pH = 6.5,且氢离子与氢氧根离子物质的量相等,此溶液呈_____性。测定温度______室温(填高于、低于或等于),其理由是 。 将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合。
(1)若所得混合液为中性,则a?b 。
(2)若所得混合液的pH=2,则a?b 。
22、水的电离平衡曲线如图所示。

(1) 若以A点表示25℃时水的电离平衡的离子浓度,当温度升高到100℃时,水的电离平衡状态移动到B点,则此时水的离子积从________变化到_________。
(2) 将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持100℃的恒温,致使混合溶液的pH=7,则Ba(OH)2和盐酸的体积比为__________________。
(3) 已知AnBm的离子积为[c(Am+)]n[c(Bn-)]m,若某温度下Ca(OH)2的溶解度为0.74g,设饱和溶液的密度为1g/mL,其离子积约为______________。
三 计算题
23、某温度下的溶液中c (H+)=1.0×10x mol/L,c (OH-)=1.0×10y mol/L。x与y的关系如图所示;

(1)求该温度下,中性溶液的pH。
(2)求该温度下0.01mol/LnaOH溶液的PH
(3)该温度下,pH=a的醋酸溶液与pH=b的NaOH溶液等体积混合,恰好完全反应,求此醋酸溶液中醋酸的电离度。
24.(7分)向50ml0.018mol/L的AgNO3溶液中加入50ml0.02mol/L的盐酸,生成了沉淀。如果溶液中C(Ag+)和C(Cl—)的乘积是一个常数,C(Ag+)· C(Cl—)=1.0×10—10,当溶液中C(Ag+)· C(Cl—)>常数,则有沉淀产生,反之沉淀溶解,求
(1)沉淀生成后溶液中C(Ag+)是多少?
(2)如果向沉淀生成后的溶液中再加入50mL0.001mol/L的盐酸,是否产生沉淀,为什么?
答案
1 B 2 C 3 B 4D 5 D 6 AC 7 D 8 B 9 B 10 C 11 B 12 A 13 B 14 D
15 D 16 A 17 A 18 A 19 B 20 B
21 中, 高于 。 水的离解反应:H2O=H+ +OH- 吸热反应,升温有利于水的离解,使Kw增大 (1)10?1 (2)9?2
22 (1) 10-14 10-12 (2) 2 :9 (3) 4×10-3
23(1) 7.5 (2)13 (3)1017-a-b%
24.解:⑴由Ag++Cl—=AgCl
可知沉淀后C(Cl-)=(0.02—0.018)50/(50+50)=0.001mol/L
所以C(Ag+)=1×10-10/0.001=1×10—7mol/L
⑵再加入50mL盐酸后 C(Ag+)=1×10-7×100/(100+50)=2/3×10-7mol/L
C(Cl-)=0.001mol/L
C(Ag+)×C(Cl-)=2/3×10-7х10-3=2/3•10-14<1×10-12
所以不产生沉淀
北京家教中心、北京家教网、北京大学生家教网,北京一对一家教,北京家教中介
北师大家教网官方网站:http://www.beishidajiajiao.com/
相关话题:北京家教、北京家教中介、北京家教网、北京大学生家教、北京家教中心
